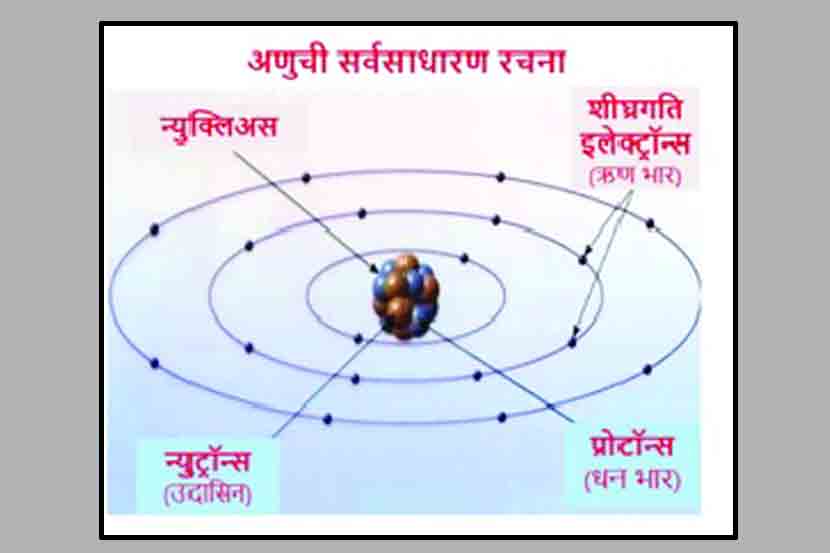
मध्यभागी केंद्रक (न्यूक्लिअस) आणि सभोवताली विशिष्ट कक्षेत फिरणारे ऋण-भारीत इलेक्ट्रॉन (e-) अशी अणूची सर्वसाधारण रचना- काहीशी सूर्याभोवती फिरणाऱ्या बुध, शुक्र, पृथ्वी, मंगळादी ग्रहांसारखी! न्यूक्लियसमध्ये धन-भारित प्रोटॉन (p+) आणि त्या सोबत उदासीन न्यूट्रॉन (n0) म्हणून सर्व धन-विद्युत भार केंद्रस्थानी. इलेक्ट्रॉनवरील ऋण-विद्युतभार आणि प्रोटॉनवरील धन-विद्युतभार एकसारखा असल्याने तसेच या अणूंमध्ये प्रोटॉनची संख्या व इलेक्ट्रॉनची संख्या एकसारखी असल्याने कोणत्याही मूलद्रव्याच्या अणूचा विद्युतभार मात्र शून्य/ उदासीन. कक्षेत फिरणाऱ्या इलेक्ट्रॉनच्या संख्येत बदल झाला तर मात्र या अणूचा विद्युतभार ऋण अथवा धन होतो आणि मग अशा अणूला ‘आयन’ म्हटले जाते.
अणू हे वस्तूचे अविभाज्य रूप म्हटले म्हणजे अणूला वस्तुमान हे आलेच. हे वस्तुमान अर्थात हा भार त्यातील इलेक्ट्रॉन, प्रोटॉन आणि न्यूट्रॉनचा असतो. इलेक्ट्रॉन आणि प्रोटॉनचा विद्युतभार एकसारखा असला तरी त्यांच्या वस्तुमानात मात्र फार फरक आहे. इलेक्ट्रॉनचे वस्तुमान प्रोटॉनच्या तुलनेत फारच कमी आणि प्रोटॉनचे वस्तुमान हे जवळपास न्यूट्रॉनच्या वस्तुमानाइतके! यामुळे एकूण पाहाता अणूचे वस्तुमान अथवा भार हा अणुच्या केंद्रस्थानी न्यूक्लिअसमध्ये एकवटलेला असतो आणि तो प्रोटॉन व न्यूट्रॉनच्या संख्येवर अवलंबून असतो. एखाद्या मूलद्रव्याच्या अणुमधील ही प्रोटॉनची संख्या म्हणजे त्या मूलद्रव्याचा ‘अणूअंक/ अणुक्रमांक (अॅटोमिक नंबर)’, या अणूच्या न्यूक्लिअसमधील प्रोटॉन अधिक न्यूट्रॉनची एकत्रित संख्या हा त्या मूलद्रव्याचा ‘वस्तुमानांक (मास नंबर)’ आणि त्यांचे एकत्रित वस्तुमान हा ‘अणू भार (अॅटोमिक मास/वेट)’. इथे महत्त्वाचा भाग म्हणजे एकाच मूलद्रव्याच्या अणू-केंद्रकात प्रोटॉनची संख्या बदलत नसली तरी न्यूट्रॉनची संख्या बदललेली असू शकते. अशा भिन्न न्यूट्रॉन-संख्या असणाऱ्या परंतु प्रोटॉन-संख्या एकच असणाऱ्या मूलद्रव्याच्या फरकास त्या मूलद्रव्याची समस्थानिके म्हणतात. उदाहरणार्थ कार्बन-१२, कार्बन-१४; यातील फरक म्हणजे कार्बन-१२च्या न्यूक्लिअसमध्ये ६ प्रोटॉन, ६ न्यूट्रॉन; कार्बन-१४च्या न्यूक्लिअसमध्ये ६ प्रोटॉन, ८ न्यूट्रॉन. हायड्रोजनची डय़ुटेरिअम व ट्रीशिअम ही समस्थानिके आपण पाहिली आहेतच. असाच प्रकार अणुबॉम्बमध्ये वापरल्या जाणाऱ्या किरणोत्सारी युरेनिअम या मूलद्रव्याचा! ९२ अणुक्रमांक असणाऱ्या या मूलद्रव्याची युरेनिअम-२३२, २३३, २३४, २३५, २३६ आणि २३८ अशी सहा समस्थनिके आहेत. ५४ अणुक्रमांक असलेल्या ‘झेनॉन’ला तर १३ समस्थानिके आहेत.
– विनायक कर्णिक
मराठी विज्ञान परिषद,
वि. ना. पुरव मार्ग, चुनाभट्टी, मुंबई २२
office@mavipamumbai.org